OKSİTLER ve ÖZELLİKLERİ
Elementlerin oksijen ile oluşturdukları bileşiklere oksit denir.
Oksitleri metal ve ametal elementleri oluştururlar. Fakat soy gazlar (He–Ne–Ar–Kr–Xe–Rn) ve halojenler (F–Cl–Br–I) oksitleri oluşturmazlar.
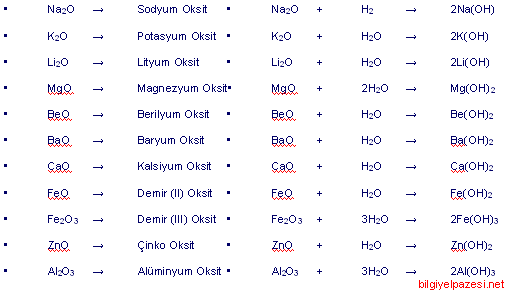
a) Metal Oksitler:
Metallerin oksijen ile oluşturdukları bileşiklere metal oksitler denir. Metal oksitlerin sulu çözeltileri baz özelliği gösterir.
b) Ametal Oksitler:
Ametallerin oksijen ile oluşturdukları bileşiklere ametal oksitler denir. Ametal oksitlerin sulu çözeltileri asit özelliği gösterir.

NOT :
1- Asit ve bazları birbirinden ayırmak için kullanılan maddelere ayıraç veya indikatör veya belirteç denir.

2- Asitler ve bazlar saf haldeyken, tuzlar da katı haldeyken elektrik akımını iletmezler.
3- Asit, baz ve tuzların sulu çözeltilerinde (+) ve (–) yüklü iyonlar birbirinden ayrıldığı için bu bileşiklerin sulu çözeltileri elektrik akımını iletirler.
4- Katı iletkenlerde elektrik akımı (–) yüklerin yani elektronların hareketi ile iletilir. Sıvı çözeltilerde ise elektrik akımı sadece (–) yüklerin değil hem (+) hem de (–) yüklerin yani iyonların hareketi sayesinde iletilir.
5- Yapısında H bulundurmasına rağmen her bileşik asit değildir.
C6H12O6 → Glikoz → Asit Değil
NH3 → Amonyak → Asit Değil
6- Yapısında OH bulundurmasına rağmen her bileşik baz değildir.
C2H5OH → Etil Alkol → Baz Değil
7- Yapısında OH bulundurmamasına rağmen sadece amonyak (NH3) bazdır.
8- Kuvvetli asitler ve bazlar suda çözündüklerinde (yani sulu çözeltileri oluşturulduğunda) tam olarak iyonlaşabilirler ve elektrik akımını iletebilirler.
9- Zayıf asitler ve bazlar suda çözündüklerinde (yani sulu çözeltileri oluşturulduğunda) tam olarak iyonlaşamadıkları için elektrik akımını iletemezler.
10- Yapısında karbon (C) elementi bulunan organik asitlerle yani meyve ve diğer besinlerde bulunan asitler zayıf asitlerdir ve tam olarak iyonlaşamazlar.
11- SO2 ve CO2 gibi bileşikler yalnız başlarına asit olamayıp suda çözündüklerinde asit özelliği gösterirler fakat zayıf asit oldukları için sulu çözeltileri elektrik akımını iletmez.
SO2 +H2O → H+ + (HSO3)–
CO2 +H2O → H+ + (HCO3)–
12- Yapısında karbon (C) bulunan asitlere organik (karboksilli) asitler denir. Organik asitlerin yapısındaki karbon (C) sayısı arttıkça asitlik kuvveti artar.
HCOOH → CH3COOH → C2H3OH(COOH)2 → Asitlik Kuvveti Artar
13- Yapısında oksijen (O) bulunan asitlere oksi asitler denir. Oksi asitlerin yapısındaki oksijen (O) sayısı arttıkça asitlik kuvveti artar.
HClO → HClO2 → HClO3 → HClO4→ Asitlik Kuvveti Artar
14- Periyodik çizelgede herhangi bir periyotta bulunan elementlerin oluşturacaklar asitlerin kuvveti, soldan sağa doğru gidildikçe artar.
Li → Be → B → N → F→ Oluşturacakları Asitlerin Kuvveti Artar
15- Periyodik çizelgede herhangi bir grupta bulunan elementlerin oluşturacakları asitlerin kuvveti yukarıdan aşağı inildikçe artar.
F→ HF
Cl→ HCl Asitlik Kuvveti Artar
Br→ HBr
I → HI
16- Oksijensiz asitler soy metallerle (Cu–Ag–Au–Pt–Hg) tepkime vermezler.
17- Oksijenli asitler soy metallerle tepkime verirler fakat tepkime sonucu hidrojen gazı (H2) oluşturmayıp su buharı (H2O) açığa çıkarırlar.
18- Bazı metallere hem asitler hem de bazlar etki edebilir. Böyle metallere amfoter metaller (maddeler) denir. Al ve Zn amfoter metallerdir.
19- Bazı oksitlerin sulu çözeltileri hem asidik hem de bazik özellik gösterirler. Asidik ve bazik özellik gösterebilen oksitlere amfoter oksitler denir. Al2O3 ve ZnO amfoter oksitlerdir.
20- Bir çözeltideki hidrojen iyonlarının (H+) miktarında (derişimine) pH değeri denir. pH değeri pH kağıdı veya pH metre ile ölçülür.
• Çözeltinin pH değeri; 0 – 7 arasında ise çözelti ASİTTİR.
• Çözeltinin pH değeri; 7 ise çözelti NÖTRDÜR.
• Çözeltinin pH değeri; 7– 14 arasında ise çözelti BAZDIR.
21- pH değeri küçüldükçe asitlik kuvveti artar, bazlık kuvveti azalır.
pH değeri büyüdükçe asitlik kuvveti azalır, bazlık kuvveti artar.
22- Kireç suyu karbondioksit (CO2) gazının ayıracıdır. Kireç suyu karbondioksit gazını (CO2 yi) bulandırır.
23- İyot çözeltisi nişastanın ayıracıdır ve nişastayı mavi veya kahverengi renge boyar.
23-
• Kuvvetli asitler tahta, metal, kağıt, mermer, kumaş gibi (bilgi yelpazesi.net) maddelere etki ederek bunları yakabilirler.
