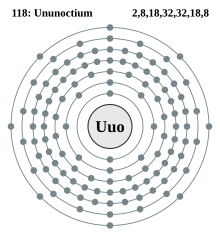
Ununoktiyum
Ununoktiyum (Uuo), eka-radon veya 118. element olarak da bilinen 118 atom numaralı transaktinit elementtir. Ununoktiyum ve Uuo, IUPAC tarafından bu element için verilmiş geçici isim ve sembollerdir.[8] Ununoktiyum "bir-bir-sekiz-yum"un Dog Latin ifadesidir. Periyodik tabloda p bloğunda yer alır ve 7. periyodun son elementidir. Ununoktiyum 18. gruptaki tek sentetik elementtir. Keşfedilen elementler içinde en büyük atom numarasına ve atom kütlesine sahip olanıdır.
Radyoaktif ununoktiyum son derece kararsızdır, ve 2002'den beri 294Uuo izotopunun yalnızca üç (belki dört) atomu algılanabilmiştir.[9] Bu durum, elementin özelliklerinin ve olası bileşiklerinin deneysel olarak belirlenmesine çok az izin verse de, kuramsal hesaplamalar, bazıları beklenmedik olmak üzere birçok öngörüye izin vermektedir. Örneğin 18. grup elementi olmasına rağmen, diğer 18. grup elementlerinin tamamı soygaz iken, ununoktiyum olasılıkla bir soygaz değil.[1] Önceleri elementin gaz olduğu düşünülüyordu ancak şimdi, rölativistik etkilerden dolayı normal şartlar altında bir katı olduğu tahmin edilmektedir.[1]
Başarısız denemeler
1998'in sonunda Polonyalı fizikçi Robert Smolańczuk, 118. elementin de dahil olduğu süperağır atomların sentezi doğrultusunda atomik çekirdeğin füzyonuna ilişkin hesaplamlar yayımladı.[10] Smolańczuk'un hesaplamaları 118. elementin, dikkatlice kontrol edilen şartlar altında kurşunun kripton ile füzyonuyla elde edilebileceğini ortaya attı.[10]
1999'da Lawrence Berkeley Ulusal Laboratuvarı'nda araştırmacılar bu öngörüleri kullandılar ve Physical Review Letters'ta[11] ve hemen ardından Science'ta[12] yayımlanan makalelerle, 116. ve 118. elementlerin keşfini duyurdular. Araştırmacıların iddiasına göre gerçekleştirilen reaksiyon;
- 8636Kr + 20882Pb → 293118Uuo + n, şeklindeydi.
Ertesi yıl diğer laboratuvarlardaki araştırmacılar sonuçları tekrarlayamayınca ve Berkeley laboratuvarı da kendisini tekrarlayamayınca bir tekzip yayımladılar.[13] Science dergisi de makaleyi geri çekip okurlarından özür diledi.[14] Haziran 2002'de laboratuvarın direktörü bu iki elementin keşfi iddiasının baş yazar Victor Ninov'un uydurma verilerinden türediğini duyurdu.[15]
Keşif
Ununoktiyum atomlarının ilk bozunumu 2002'de Dubna, Rusya'daki Ortak Nükleer Araştırma Enstitüsü'nde (Joint Institute for Nuclear Research-JINR) gözlendi.[16] 9 Ekim 2006'da Dubna'da, JINR ve Kaliforniya, ABD'deki Lawrence Livermore Ulusal Laboratuvarı'ndaki bilim insanları, kaliforniyum-249 atomları ve kalsiyum-48 iyonlarının çarpıştırılması ile üretilen toplam üç (ya da dört) ununoktiyum-294 atomunu (bir veya iki tane 2002'de ve iki tane daha 2005'te) doğrudan olmayan yöntemle algıladıklarını duyurdular.[17][18][19][20][21]
- 24998Cf + 4820Ca → 294118Uuo + 3 n.

Çok düşük füzyon reaksiyonu olasılığından dolayı (füzyon reaksiyonu tesir kesiti ~0.3–0.6 pb = (3–6)×10−41 m2'dir) deney dört ay sürdü ve ununoktiyum sentezi olduğuna inanılan ilk kaydedilmiş olayı gerçekleştirmek için kaliforniyum hedefe çarpıştırılacak 4×1019 kalsiyum iyonu içeriyordu.[6] Buna rağmen araştırmacılar sonucun bir yalancı pozitif olmadığından emindi, çünkü tespitlerin rasgele olaylar olma şansı yaklaşık 100,000'de birdi.[22]
Deneylerde ununoktiyum atomlarından üçünün alfa bozunması gözlendi. Doğrudan kendiliğinden fisyon ile meydana gelen dördüncü bir bozunma ayrıca ortaya atıldı. 0.89 ms'lik bir yarı ömür hesaplandı. 294Uuo alfa bozunması ile 290Uuh'ye dönüşür. Sadece üç çekirdek olduğundan yarı ömür, büyük bir kesinsizlikle (0.89+1.07−0.31 ms) gözlenen yaşam sürelerinden türetildi.[7]
- 294118Uuo → 290116Uuh + 4He
294Uuo çekirdeklerinin tanılanması, 245Cm'nin 48Ca iyonları ile bombardıman edilmesiyle ayrı ayrı yaratılan, varsayılan kız çekirdek 290Uuh ile ve 290Uuh bozunumunun 294Uuo çekirdeklerinin bozunum zinciri ile uygunluk gösterdiğinin kontrolüyle doğrulandı.[7]
- 24596Cm + 4820Ca → 290116Uuh + 3 n.
Kız çekirdek 290Uuh çok kararsızdır ve 14 milisaniyelik yarı ömrü ile 286Uuq'ye bozunur. Sonrasında kendiliğinden fisyona uğrayabilir veya alfa bozunması ile kendiliğinden fisyona uğrayacak olan 282Uub'ye bozunabilir.[7]
Kuantum tünelleme modelinde, 2004'te yayınlanan deneysel Q değeri ile 294Uuo'nun alfa bozunması yarı ömrü 0.66+0.23−0.18 ms[23] olarak tahmin edildi.[24] Makroskobik-mikroskobik Muntian–Hofman–Patyk–Sobiczewski modelindeki kuramsal Q değeri ile yapılan hesaplamalar, bir miktar daha düşük olmakla birlikte karşılaştırılabilir sonuçlar vermektedir.[25]
Ununoktiyumun başarılı bir şekilde elde edilmesinin ardından kaşifler, 58Fe ve 244Pu'den unbinilyumu elde edebilmek umuduyla benzer deneyler yapmaya başladılar.[26] Unbinilyum izotoplarının alfa bozunması yarı ömürlerinin mikro saniyeler mertebesinde olduğu tahmin edilmektedir.[27][28]
Adlandırma
1960'lara kadar ununoktiyum eka-emanation (emanation radonun eski adıdır) olarak biliniyordu. 1979'da IUPAC ununoktiyum olarak anılacak element için öneriler yayımladı. Ununoktiyum (bir-bir-sekiz-yum), elementin keşfi onaylanıncaya ve IUPAC isimde karar verinceye kadar, yer tutucu olan bir sistematik element adıdır.[29] 118. elementin keşfi uzun süredir geniş çapta kabul görse de IUPC henüz onaylamadığı için ununoktiyum ismi halen kullanımdadır. Ayrıca keşfin arkasında bulunan iki ekip (Ruslar-ABD'liler) arasında da, adlandırma konusunda bir konsensus yoktur.
2002'deki geri çekilmeden önce Berkeley'deki araştırmacılar elementi, araştırma ekibinin lideri olan ve daha önceki 95 ve 106 atom numaraları arasındaki on iki elementin de keşfinde yer alan Albert Ghiorso'ya ithafen ghiorsium (Gh) olarak isimlendirmeyi planlamışlardı.[30]
Rus kaşifler sentezlerini 2006'da rapor ettiler. Keşfin arkasında bulunan JINR'deki Flerov Nükleer Tepkimeler Laboratuvarı (FNTL) çalışanlarının ilk isim önerileri Dubnadyum (Dn) oldu. Ancak bu terim ekibin daha önce keşfedip adlandırdıkları Dubniyum (Db) elementi ile büyük benzerlik gösteriyordu. 2007'de Rus enstitüsünün başkanı, bir Rus dergisine verdiği röportajda ekibin iki isim üzerinde karar vermeye çalıştığını duyurdu: Dubna'daki araştırma laboratuvarının kurucusu Georgy Flyorov'un onuruna flyorium; ve Dubna'nın bulunduğu Moskovskaya Oblastı'ndan dolayı moskovyum.[31] Başkan ayrıca, elementin kaliforniyum hedefleri sağlayan Amerikalılarla işbirliği içinde keşfedilmiş olmasına karşın elementin Rusya'nın onuruna isimlendirilmesi gerektiğini çünkü JINR'deki Flerov Nükleer Tepkimeler Laboratuvarı'nın dünyada bu işin başarılabileceği tek tesis olduğunu belirtti.[32][33] Ancak daha sonra bu isimler 114. element (flerovyum) ve 116. element (moskovyum) için önerildi.[34]
118. elementin adı halen resmi olarak ununoktiyumdur. Ancak bazı Rus kökenli yazılarda element anılırken moskovyum (Kiril: московий) adı ve Mk simgesi kullanılmaktadır. Genel olarak bilimsel yazılarda element için herhangi bir sistematik ad yerine atom numarası kullanımı tercih edilir. Ununoktiyum 118. element olarak anılırken, elementin izotopu olan ununoktiyum-294 de 294118 şeklinde gösterilir.
Özellikleri
Çekirdek kararlılığı ve izotopları
Atom numarası 83'ün üzerinde (bizmuttan sonra) olan hiçbir elementin kararlı izotopu yoktur. Atom numarasının artmasıyla çekirdek kararlılığı azalır, öyle ki atom numarası 101'in üzerinde olan elementler bir günün altındaki yarı ömürleri ile radyoaktif bozunuma uğrarlar. Buna rağmen henüz tam olarak anlaşılamayan sebeplerden dolayı 110 ve 114. elementler arasında çekirdek kararlılığı bir miktar artar. Bu durum çekirdek fiziğinde "kararlılık adası" olarak bilinen görünümün ortaya çıkmasına sebep olur. Süperağır elementlerin, öngörülenden daha uzun ömürlü olmasını açıklayan bu kavram UC Berkeley profesörü Glenn Seaborg tarafından ortaya atıldı.[35] Ununoktiyum radyoaktiftir ve yarı ömrü 1 milisaniyeden daha azdır. Yine de bu bazı öngörülen değerlerden yüksektir.[36]. Bu da kararlılık adası için bir başka destek anlamına gelir.[37]
Kuantum tünelleme modeli kullanılarak yapılan hesaplamalar 118. elementin, alfa bozunumu yarı ömürleri 1 ms'ye yakın olan birkaç nötron zengini izotopunun var olduğunu öngermektedir.[27]
Diğer izotopların yarı ömürleri ve sentetik yolları üzerinde yapılan hesaplamalar bazılarının sentezlenmiş izotop 294Uuo'dan az bir miktar daha kararlı olduğunu gösterdi (bunlar büyük ihtimalle 293Uuo, 295Uuo, 296Uuo, 297Uuo, 298Uuo, 300Uuo ve 302Uuo'dur).[23][38] Bunlar içerisinde 297Uuo daha uzun ömürlü çekirdek konusunda en iyi şansı sunabilir[23][38] ve böylece element üzerinde gelecekte yapılacak çalışmaların odak noktası haline gelebilir. 313Uuo civarındaki bazı çok nötrona sahip izotoplar da uzun ömürlü çekirdek sağlayabilir.[39]
Atomik ve fiziksel özellikleri
Ununoktiyum, sıfır valanslı elementlerin bulunduğu 18. grubun bir üyesidir. En dış valans kabuğu 8 elektronla tamamen dolu olan bu grubun üyeleri genellikle çoğu kimyasal reaksiyona (örneğin yanma) karşı inerttirler.[40] Bu da dış elektronların sıkıca bağlı olduğu kararlı, minimum enerji konfigürasyonuna anlamına gelir. Buna benzer şekilde ununoktiyumun da, valans elektronları 7s27p6 diziliminde olmak üzere, kapalı bir valans kabuğuna sahip olduğu düşünülmektedir.[1]
Sonuç olarak bazıları, ununoktiyumun grubunda bulunan diğer elementler ile (özellikle de periyodik tabloda hemen üstünde bulunan radon ile) benzer fiziksel ve kimyasal özelliklere sahip olmasını beklerler.[41] Periyodik tablodaki eğilim göz önünde bulundurulduğunda ununoktiyumun, radondan bir miktar daha fazla reaktif olması gerekirdi. Ancak kuramsal hesaplamalar elementin beklenenden çok daha fazla reaktif olabileceğini gösterdi. Bu yüzden ununoktiyum soygaz olarak nitelendirilemeyebilir.[4] Radondan çok daha fazla reaktif olmasının yanısıra ununoktiyum, ununkuadyum ve kopernikyumdan bile daha reaktif olabilir.[1] Ununoktiyumun kimyasal reaktifliğinin radona göre bariz bir şekilde yüksek olmasının sebebi, son işgal edilen 7p alt kabuğunun istikrarsızlığı ve radyal genişlemesidir.[1][42]
Ununoktiyum, periyodik tabloda kendisinden önce gelen tüm elementlerden daha yüksek bir kutuplanabilirliğe (neredeyse radonun sahip olduğu kutuplanabilirlik değerinin iki katına) sahiptir.[1] Bu devasa kutuplanabilirlik değerinden ötürü, elementin anormal derecede düşük bir iyonlaşma enerjisine sahip olduğu tahim edilmektedir. Bu enerji değerinin, radonun iyonlaşma enerjisinin yüzde yetmişine sahip olan kurşununki ile benzer[43] ve ununkuadyumunkinden önemli ölçüde düşük olduğu düşünülmektedir.[44] Diğer soygazlardan yola çıkılırsa kaynama noktasının 320 ve 380 K arasında olduğu tahmin edilmektedir.[1] Bu daha önceki 263 K[5] veya 247 K[45] tahminlerinden oldukça farklıdır. Deney sonuçları oldukça kuşkulu olsa da ununoktiyumun standart sıcaklık ve basınç altında gaz olma ihtimali çok düşüktür.[1] Ayrıca diğer gazların sıvı halde bulunma aralıklarının epey dar (2 ve 9 kelvin arasında) olduğu düşünüldüğünde, bu elementin standart şartlarda katı olması gerekir. Bununla birlikte ununoktiyum standart şartlarda gaz halinde bulunuyor ise (diğer soygazlar gibi tek atomlu olsa bile), gaz haldeki en yoğun maddelerden biri olması gerekir.
Tahmini bileşikleri
Şimdiye kadar herhangi bir ununoktiyum bileşiği sentezlenebilmiş değildir. Bununla birlikte, 1964'ten beri kuramsal bileşikler üzerine çalışmalar devam etmektedir.[46] İyonizasyon enerjisi yeterince yüksekse, (diğer soygazlar gibi) elementin oksitlenmesinin de bir o kadar zor olması ve böylece en yaygın oksidasyon durumunun da 0 olması beklenmektedir.[47]
 |
 |
|
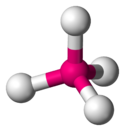
| Ununoktiyum tetraflorür (UuoF4) molekülü tetrahedral bir yapıya sahiptir. | Ksenon tetraflorür (XeF4) ve radon tetraflorür (RnF4) molekülleri kare düzlem bir yapıya sahiptir. |
Dimer molekülü Uuo2konusundaki hesaplamalar, bu molekülün bağ etkileşiminin kabaca Hg2 molekülününkine benzediğini ve bağ ayrışma enerjisinin de Rn2'dekinin 2 katına eşit olduğunu gösterdi.[1] Ancak çok şaşırtıcı bir şekilde, Uuo2'deki bağ uzunluğunun Rn2'dekinden 0.16 Å kadar daha kısa olarak hesaplanmış olmasıdır.[1] Bağ uzunluğu, önemli bağ etkileşimlerindeki belirleyici bir etmendir. Diğer taraftan UuoH+, RnH+'den daha düşük bir ayrışma enerjisi göstermektedir.[1]
UuoH bileşiğinde, ununoktiyum ve hidrojen arasındaki bağ çok esnektir ve gerçek bir kimyasal bağdan ziyade van der Waals etkileşimi olarak kabul edilir.[43] Diğer taraftan ununoktiyumun, yüksek elektronegatifliğe sahip elementler ile, kopernikyum ve ununkuadyumun yapacağından daha kararlı bileşikler oluşturacağı tahmin edilmektedir.[43] +2 ve +4 kararlı oksidasyon durumlarının, UuoF2 and UuoF4 gibi florlu bileşiklerde varlığını göstereceği öngörülmektedir.[48] Bu, ununoktiyumu alışılmışın dışında reaktif yapan aynı spin-orbit etkileşiminin sonucudur. Örneğin UuoF2 bileşiğini oluşturan Uuo ve F2 arasındaki reaksiyonla 106 kcal/mol enerji açığa çıkar, bu enerjinin 49 kcal/mol kadarı spin-orbit etkileşiminden gelir.[43] Benzer bir molekül olan RnF2'de, oluşma enerjisi 49 kcal/molün yaklaşık 10 kcal/molü aynı etkileşimden gelir.[43]
Şimdiye kadar sadece dört ununoktiyum atomu üretilebildiğinden elementin, temel bilimsel araştırmalar dışında herhangi bir kullanımı söz konusu değildir.Ununoktiyum (Uuo), eka-radon veya 118. element olarak da bilinen 118 atom numaralı transaktinit elementtir. Ununoktiyum ve Uuo, IUPAC tarafından bu element için verilmiş geçici isim ve sembollerdir. Ununoktiyum "bir-bir-sekiz-yum"un Dog Latin ifadesidir. Periyodik tabloda p bloğunda yer alır ve 7. periyodun son elementidir. Ununoktiyum 18. gruptaki tek sentetik elementtir. Keşfedilen elementler içinde en büyük atom numarasına ve atom kütlesine sahip olanıdır.
Radyoaktif ununoktiyum son derece kararsızdır, ve 2002'den beri 294Uuo izotopunun yalnızca üç (belki dört) atomu algılanabilmiştir. Bu durum, elementin özelliklerinin ve olası bileşiklerinin deneysel olarak belirlenmesine çok az izin verse de, kuramsal hesaplamalar, bazıları beklenmedik olmak üzere birçok öngörüye izin vermektedir. Örneğin 18. grup elementi olmasına rağmen, diğer 18. grup elementlerinin tamamı soygaz iken, ununoktiyum olasılıkla bir soygaz değil. Önceleri elementin gaz olduğu düşünülüyordu ancak şimdi, rölativistik etkilerden dolayı normal şartlar altında bir katı olduğu tahmin edilmektedir.